Si vous souhaitez participer à l’étude en cours, veuillez nous contacter à clinical@ab-science.com
La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative rare et potentiellement mortelle, caractérisée par une paralysie musculaire progressive reflétant une dégénérescence des neurones moteurs. La SLA est associée à une morbidité importante et a de graves répercussions sur le fonctionnement quotidien. La maladie est implacablement progressive.
Il existe toujours un fort besoin de nouveaux traitements pour la SLA. En Europe, aucun médicament n’a été enregistré depuis le riluzole, il y a 32 ans.
Le masitinib est actuellement le seul inhibiteur de la tyrosine kinase en phase avancée de développement pour la SLA. Le masitinib se distingue des autres médicaments dans le développement de la SLA en exerçant une neuroprotection dans les systèmes nerveux central et périphérique.
Le masitinib apparait comme unique parmi les autres médicaments utilisés dans le développement de la SLA, car il exerce une neuroprotection à la fois dans le système nerveux central et dans le système nerveux périphérique par l’inhibition sélective des kinases qui modulent la fonctionnalité des différentes cellules impliquées dans la pathogenèse de la SLA.
En reconnaissance du besoin critique de nouveaux traitements, le masitinib a reçu la désignation de médicament orphelin pour la SLA à la fois de l’Agence Européenne du Médicament (EMA) et de la Food and Drug Administration (FDA) des États-Unis.
AB Science a rapporté des résultats positifs de phase 2B/3 avec le masitinib dans la SLA. Dans cette étude, le masitinib en association avec le riluzole a permis de retarder de manière significative (-27%) la progression de la maladie chez les patients atteints de SLA identifiés comme progressant normalement, ce qui constituait la population de l’analyse primaire (c’est-à-dire les patients dont la progression de l’ALSFRS-R au départ était <1,1 point/mois).
Analyse primaire – Évolution du score ALSFRS par rapport au niveau de référence
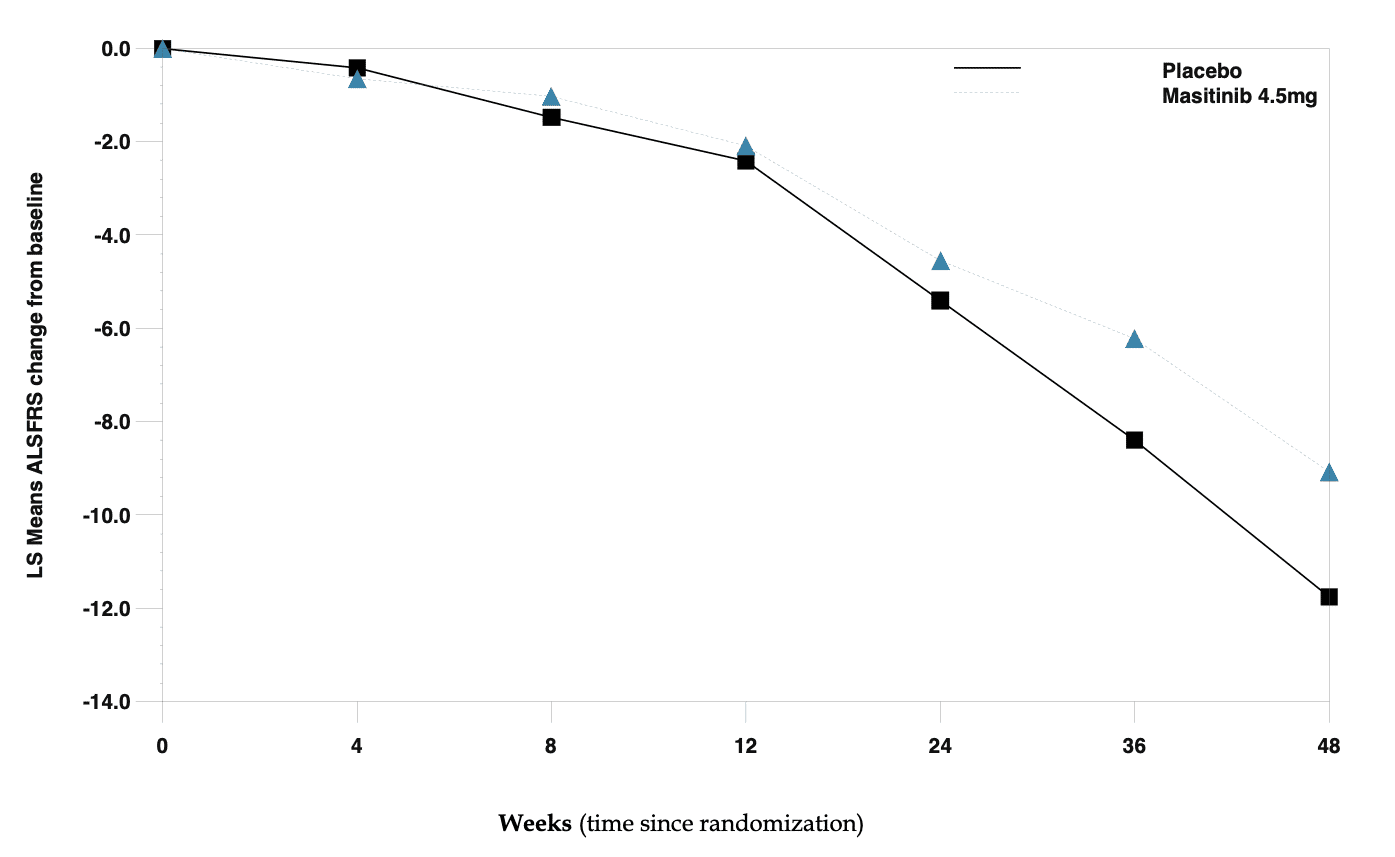
Les résultats de l’étude ont été publiés dans la revue Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration (ALSFD) et représentent le premier essai positif de phase 3 d’un inhibiteur de la tyrosine kinase dans la SLA.
Une analyse de survie a concerné tous les patients initialement recrutés dans l’étude AB10015 pendant une durée moyenne de 75 mois à partir de la date du diagnostic. Chez les patients atteints de SLA dont la sévérité de la maladie était légère ou modérée au moment de l’inclusion, il a été observé que le traitement avec le masitinib à la dose de 4,5 mg/kg/jour en association au riluzole prolongeait la survie de 25 mois par rapport aux patients traités par le riluzole seul, avec une réduction du risque de décès de 44%. Les personnes atteintes de SLA légère ou modérée correspondent étroitement à la population de patients recrutés dans l’étude confirmatoire de phase 3, AB19001. Ces nouvelles données de survie ont été publiées dans la revue examinée par des pairs Therapeutic Advances in Neurological Disorders).
Enfin, des analyses supplémentaires ont montré qu’il existe un bénéfice clairement accru dans le sous-groupe appelé “SLA avant toute perte de fonction » (c’est-à-dire excluant les patients avec un score ALSFRS-R de 0 dans l’un des 12 composants du score). En effet, un bénéfice significatif de + 12 mois en termes de survie (p = 0,0192) a été observé dans ce sous-groupe.
Une nouvelle étude confirmatoire de phase 3, simplifiée pour le recrutement et ciblant les meilleurs répondeurs au masitinib, sera initiée conformément aux recommandations de la FDA et de l’EMA. Le design de l’étude confirmatoire de Phase 3 a récemment été approuvé par la FDA et l’EMA (sytème CTIS, étape 1).
