La sclérose en plaques (SEP) est une maladie du système nerveux central (SNC) caractérisée par une dégradation progressive des cellules nerveuses du SNC par le système immunitaire du patient et se présente sous deux formes principales : la forme récurrente-rémittente caractérisée par des rechutes de la maladie et la forme progressive, caractérisée par une aggravation constante et régulière des symptômes de la maladie, sans rechute distincte ni période de récupération.
Bien que des progrès significatifs aient été réalisés dans la forme récurrente de la SEP, avec plus de 15 médicaments approuvés, il existe toujours un très fort besoin médical non satisfait pour traiter les patients atteints de SEP progressive primaire et de SEP secondairement progressive non active, aucun médicament n’étant approuvé pour la SEP secondairement progressive non active et un seul pour la SEP progressive primaire.
Dans la sclérose en plaques progressive, il a été démontré que les cellules immunitaires innées telles que les macrophages, les microglies ou les mastocytes jouent probablement un rôle majeur. Le masitinib est conçu pour les formes progressives de la sclérose en plaques, en ciblant le système immunitaire inné, en particulier les mastocytes et les microglies.
Cette étude de phase 2a a montré que pour le critère d’évaluation principal du MSFC (qui mesure les symptômes des patients sur trois aspects : mouvement des membres inférieurs, mouvement des membres supérieurs et tests cognitifs), 32% des patients traités par le masitinib ont répondu au traitement contre 0% avec le placebo. Une réponse clinique a été définie comme une variation supérieure à 100% rapport à la valeur observée à l’inclusion dans le score MSFC.
Les résultats de cette étude de phase 2a ont été publiés dans BMC Neurology.
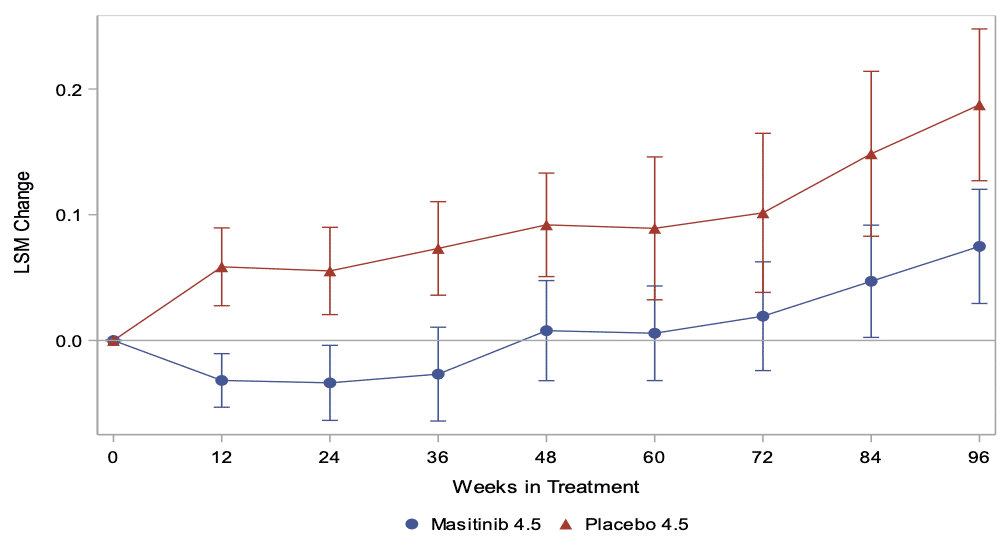
AB Science a rapporté des résultats positifs de la phase 2B/3 avec le masitinib dans les formes progressives de la SEP. Dans cette étude, le masitinib a ralenti la progression de la maladie chez les patients, ce qui était l’objectif principal de l’étude, tel que mesuré par le changement sur l’échelle EDSS (Expanded Disability Status Scale). Le masitinib a également démontré une réduction significative du risque d’atteindre un niveau de handicap suffisamment grave pour nécessiter une mobilité en fauteuil roulant.
Analyse primaire – Changement dans l’EDSS jusqu’à la semaine 96 (une valeur positive indique une aggravation)
Les résultats de l’étude ont été présentés lors de la 8e réunion conjointe des Comités Européen (ECTRIMS) et Américain (ACTRIMS) pour le Traitement et la Recherche sur la Sclérose en plaques (MSVirtual2020) et fournit les premières preuves cliniques que le ciblage du système immunitaire inné est une stratégie efficace pour le traitement des formes progressives de la sclérose en plaques.
AB Science a reçu l’autorisation pour initier une étude confirmatoire de phase 3 évaluant le masitinib chez les patients atteints de sclérose en plaques progressive primaire (PPMS) ou de sclérose en plaques secondairement progressive non-active (nSPMS). L’étude doit recruter 800 patients provenant de nombreux centres et présentant un score EDSS (Expanded Disability Status Scale) compris entre 3,0 et 6,0 et une absence de lésions cérébrales T1 rehaussées après injection de gadolinium, mesuré par IRM (imagerie par résonance magnétique). L’objectif principal de l’étude sera d’évaluer l’effet du masitinib sur le délai avant progression confirmée du handicap, la progression étant définie comme une aggravation d’un point lorsque le score EDSS à l’inclusion est inférieur ou égal à 5,5, ou d’un demi-point lorsque le score EDSS à l’inclusion est strictement supérieur à 5,5, entre la randomisation et la semaine 96.